Por Gabriel Martínez del Mármol
Actualizado: 05/04/2020
INTRODUCCIÓN
Las serpientes (Serpentes Linnaeus, 1758) están dentro del orden Squamata, de la clase Reptilia, dentro del filo Chordata (Pyron et al., 2013).
Habitan la mayor parte de biomas del planeta Tierra y dentro de este gran suborden, las víboras son probáblemente unas de las serpientes más conocidas y reconocidas.
La subfamilia, Crotalinae Oppel, 1811 tiene una amplia distribución global y, por lo tanto, un mayor número de géneros y especies dentro de esa subfamilia (Wallach et al., 2014). Esa familia, conocida como las víboras de fosetas, se encuentra en las Américas y en toda Asia desde las islas del sudeste asiático (Filipinas-Indonesia) en el este, hasta Azerbaiyán en el oeste (McDiarmid et al., 1999; Gloyd y Conant 1990). En esta subfamilia encontramos géneros con extrema variabilidad fenotípica, como las serpientes de cascabel del género Crotalus Linnaeus 1758. También se incluyen en esta subfamilia las víboras más largas de la Tierra, las del género Lachesis Daudin, 1803, y la gran variabilidad de las víboras arbóreas que se encuentran dentro de los géneros Bothriechis Peters 1859, Trimeresurus Lacépède 1804 y Tropidolaemus Wagler 1830. Recientemente se han descrito varios géneros nuevos (Cryptelytrops, Himalayophis, Parias, Peltopelor, Popeia y Viridovipera) Malhotra y Thorpe 2004. Varias especies son bastante expertas en camuflaje como los del género Agkistrodon Palisot de Beauvois 1799 y Protobothrops Hoge y Romano-Hoge 1983. Algunas víboras, como las del género Gloydius Hoge y Romano-Hoge 1981 se pueden encontrar a gran altura, incluso alcanzando elevaciones de hasta 4.880 m (16,000 pies) (Mc Diarmid et al., 1999; Shi et al., 2017).
Pero es en las víboras verdaderas o del Viejo Mundo donde podemos encontrar a la familia con las adaptaciones fenotípicas más extremas. Además de la víbora de cola de araña, Pseudocerastes urarachnoides Bostanchi, Anderson & Papenfuss 2006, que tiene el mecanismo de señuelo más avanzado en todo el reino animal, son serpientes del género, Bitis Gray 1842, donde encontramos los más diversos ejemplos de variabilidad fenotípica de todas las víboras, y probablemente en todas las especies de serpientes.
Mientras que, por ejemplo, el género Daboia Gray 1842 tiene la mayor distribución geográfica, extendiéndose desde la costa atlántica de Marruecos en el oeste hasta las islas de Indonesia en el este (Das, 2012), el género Bitis es casi exclusivo de África, y más específicamente, del África subsahariana (Phelps 2010). De hecho, aunque hay algunas poblaciones pequeñas en Arabia y África del Norte, es en África subsahariana donde el género alcanza sus rasgos evolutivos más diversos y variados
LAS ESPECIES DE BITIS
La extrema varibilidad fenotípica está también reflejada genéticamente. Lenk y colaboradores (1999) utilizaron datos moleculares (distancias inmunológicas y secuencias de ADN mitocondrial) para estimar las relaciones filogenéticas entre las diversas especies de Bitis e identificaron cuatro grupos monofiléticos principales para los cuales crearon cuatro subgéneros. Otros análisis han confirmado esta diversificación genética en el género Bitis (Barlow et al., 2013; Pyron et al., 2013; Barlow et al., 2019, Fig. 1)
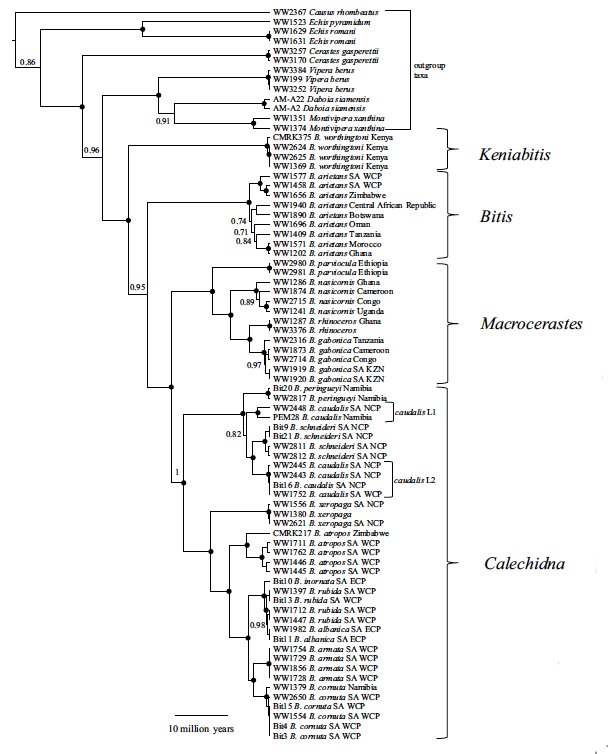
1) BITIS
El subgénero Bitis está compuesto por una especie única, Bitis arietans (Merrem, 1820). Bitis arietans se conoce comúnmente como una víbora bufadora, porque cuando se siente amenazada, a menudo resopla muy fuerte como una advertencia antes de atacar.
Los adultos promedian menos de un metro de longitud total, aunque algunos especímenes pueden alcanzar longitudes de más de 120 cm (Marlow et al., 2003). Sin embargo, como especie son serpientes muy robustas y voluminosas, por lo que, aunque no son muy largas, son serpientes de aspecto bastante impresionante.

Como la mayoría de las especies de Bitis, generalmente se mueven lentamente y con una locomoción rectilínea, aunque si se sienten amenazadas, pueden moverse con movimientos rápidos de desplazamiento lateral y pueden desaparecer bastante rápido, especialmente si encuentran un lugar de refugio.
En Sudáfrica, la coloración y el patrón pueden variar dramáticamente incluso en individuos dentro de una sola población, mientras que en Marruecos, por ejemplo, la variabilidad de los patrones y la coloración es muy consistente (Martínez del Mármol et al., 2019). En general, la coloración y el patrón del cuerpo son muy similares al hábitat donde vive la serpiente, lo que ayuda a que se mezcle con su entorno.
Como la mayoría de las víboras, el género Bitis se especializa en la caza por emboscada a su presa (Marais 2004; Miller et al., 2015).
En la mayoría de las regiones de África, las Bitis arietans se encuentran en pastizales y sabanas, mientras que en Arabia (al menos en Omán) están restringidos a los alrededores de los ríos en las áreas influenciadas por los monzones estacionales (Arnold 1980; Carranza et al., 2018 ). En Marruecos, también tienen una presencia más limitada debido al clima que al hábitat. En la zona costera, desde el valle de Souss hasta Dahkla, se pueden encontrar en una gran variedad de lugares, como los ríos circundantes y las zonas rocosas, pero su hábitat preferido son las grandes estepas con suelo arenoso y abundancia de madrigueras de mamíferos.

En Marruecos, las víboras bufadoras son unas de las pocas serpientes que se pueden encontrar activas durante todo el año. Los registros de observaciones de febrero hasta mayo y nuevamente en agosto hasta diciembre indican que su período de actividad es diferente al de otras serpientes de tipo mediterráneo, y parece depender más de las lluvias para estar activas que la estación del año. Una situación similar también ocurre en Marruecos con la culebra Dasypeltis sahelensis Trape & Mané 2006 (Jiménez Robles et al., 2017)
Aunque parece ser una especie relicta (Bons y Geniez 1996), Bitis arietans es muy abundante en Marruecos, probablemente porque en Marruecos esta especie da a luz a un gran número de recién nacidos. En general, esta especie puede promediar camadas de más de 50 crías, lo cual es bastante típico; y una hembra, originaria de Kenia y mantenida en un zoológico checo, dio a luz a 156 crías, la camada más grande conocida para cualquier especie de serpiente (Mehrtens 1987, Spawls et al., 2004).
Actualmente se reconocen dos subespecies: Bitis arietans somalica, Parker 1949 para algunas poblaciones en Somalia y el norte de Kenia (figura 4.6), y la subespecie nominal para las poblaciones restantes (figura 4 sin incluir 4.6). Eso no parece reflejar la diversidad correcta en la especie, donde hay al menos tres grandes clados según los análisis genético: 1) Marruecos, Arabia, África occidental y parte de África oriental; 2) África central y otras partes de África oriental; y 3) poblaciones del sur de África donde también se ha informado una gran diversidad (Barlow et al., 2013). Parece que podría ser necesaria una revisión de esta especie, una que sería de gran importancia, tanto biológica como médicamente para África.

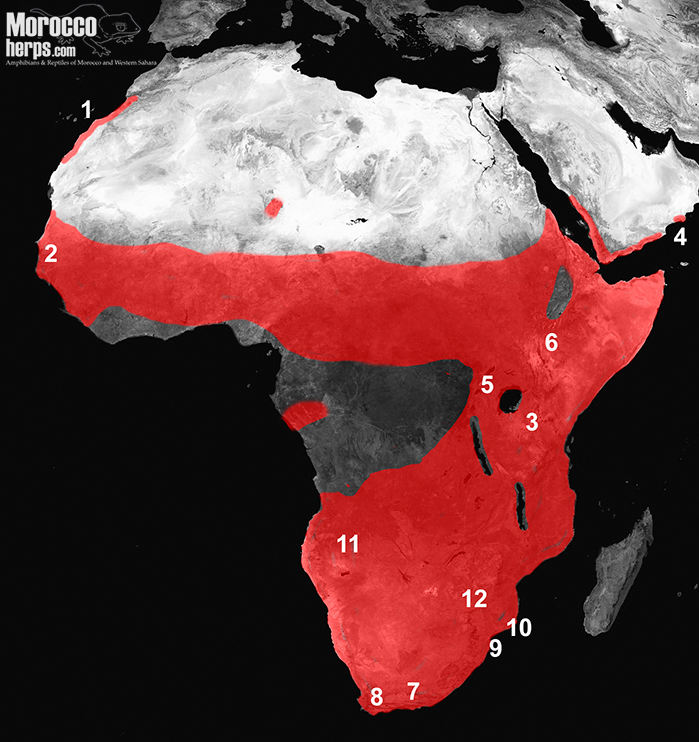
Su excelente camuflaje, alta capacidad reproductiva, potente veneno y ataque rápido lo convierten en uno de los depredadores más exitosos de África, aunque desafortunadamente, también son responsables de numerosas muertes humanas por mordedura de serpiente en África (Mallow et al., 2004).
2) CALECHIDNA
Este subgénero consta de las víboras pequeñas / enanas que se pueden agrupar en 2 grandes clados (Barlow et al., 2019):
- El clado arenícola (víboras de «arena»): complejo de especies de Bitis caudalis (A.Smith 1839), Bitis schneideri (Boettger 1886), Bitis peringueyi (Boulenger 1888).
- El clado rupícola (víboras de «roca»): Bitis xeropaga Haacke 1975, Bitis atropos (Linnaeus 1758), Bitis cornuta (Daudin, 1803), Bitis inornata (Smith, 1838), Bitis rubida Branch 1997, Bitis albanica Hewitt 1937 y Bitis armata (Smith 1826).
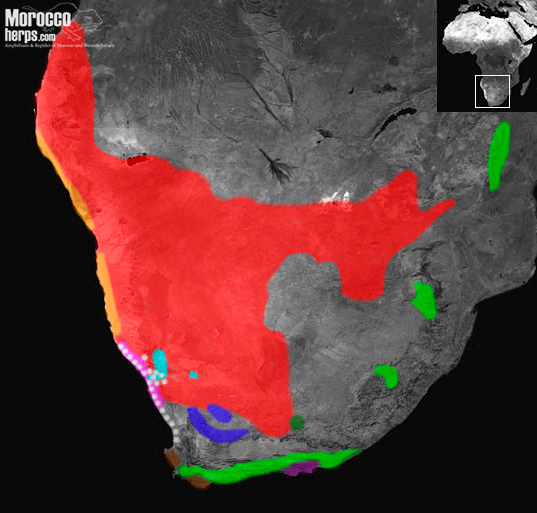

LAS VÍBORAS DE LA ARENA
En el desierto del Sahara y Oriente Medio, las víboras especializadas en vivir en hábitats arenosos son miembros del género Cerastes Laurenti 1768. En el desierto de Baluchistán, las víboras especializadas que viven en entornos arenosos pertenecen al género Eristicophis Alcock y Finn, 1897. Dentro de las víboras de fosetas, Crotalus cerastes, Hallowell 1854, habita los desiertos de algunas regiones del suroeste de los Estados Unidos y México. En el desierto de Namib, en el suroeste de África, considerado el desierto más antiguo de la Tierra, son las víboras del género Bitis las que han colonizado con mayor éxito la región.

En el sur de Marruecos, Cerastes vipera (Linneaus 1758) es la especie de víbora que predomina en las grandes dunas de arena. Estas serpientes tienen ojos que están casi completamente en la parte superior de su cabeza, lo que indica que son especialistas en emboscadas y esperan a sus presas permaneciendo casi completamente ocultas y enterradas debajo de la arena con solo sus ojos expuestos. Este comportamiento es casi idéntico al de Bitis peringueyi. Ambas especies son de tamaño similar, tienen sus ojos en lugares similares y comparten estrategias de caza similares. Ambas especies prefieren los límites de las grandes dunas, donde hay numerosos arbustos pequeños en los que pueden esconderse. Una situación similar ocurre en la familia Boidae, Gray 1825, en la especie Eryx jayakari Boulenger 1888, donde las serpientes comparten una adaptación similar para vivir en las dunas.

En el sur de Marruecos hay otra especie de víbora que habita en las grandes regiones de dunas: Cerastes cerastes (Linneaus, 1758). Mientras que Cerastes vipera tienen un hábitat más restringido a las áreas arenosas (con algunas excepciones, Bouazza et al. 2020), la otra especie de víbora también habita hábitats rocosos. Cerastes cerastes es una especie más grande, y la mayoría de las poblaciones tienen escamas que se parecen a cuernos sobre cada ojo, y algunas pueden tener patrones de coloración muy variables. Una situación similar ocurre en el sur de África con Bitis caudalis. Se han encontrado junto con Bitis peringueyi en muchos lugares, aunque no están tan especializados en vivir en dunas de arena, y se pueden encontrar en grandes estepas rocosas y hábitats intermedios.

Los análisis genéticos han mostrado al menos 2 linajes genéticos diferentes dentro de Bitis caudalis, uno relacionado con Bitis schneideri, especie considerada como la víbora más pequeña del mundo con un tamaño promedio de 20 cm y un tamaño máximo de 28 cm (Barlow et al.2019; Marais 2020).


VÍBORAS DE ROCA
Bitis xeropaga, Bitis atropos, Bitis cornuta, Bitis inornata, Bitis rubida, Bitis albanica y Bitis armata son especies de víboras pequeñas a medianas que rara vez superan los 50 cm de longitud y habitan principalmente hábitats rocosos y pastizales en las montañas o áreas costeras en el sur de África.
Una de las especies más singulares de víboras es Bitis cornuta. Si bien hay varios géneros de víboras con cuernos en la cabeza: por ejemplo Crotalus Linneaeus 1758, Cerastes Laurenti 1768, Ophryacus Cope 1887 y Bothriechis Peters 1859, ninguno de ellos posee cuernos en la cabeza similares a los de Bitis cornuta.

La especie Bitis atropos puede vivir en biomas de hasta 3.000 m (9.850 pies) de altitud, en un hábitat de montaña donde, en otras partes del mundo, por ejemplo, Europa, Oriente Medio o el norte de África, uno esperaría encontrar individuos de los géneros, Vipera Laurenti 1768 o Montivipera Nilson, Tuniyev, Andren, Orlov, Joger & Herrmann 1999. Son extremadamente variables en cuanto a diseño y color, y pueden vivir en hábitats de montaña y en zonas costeras. Fitzimons (1959) describió la subespecie B. atropos unicolor principalmente como «casi uniformemente de color caqui a marrón rojizo en la parte dorsal y aparentemente una serpiente más pequeña que las atropos típicas».

Bitis rubida es una especie endémica de varias montañas de Sudáfrica (montañas Cape Fold desde Cederberg en el norte hasta las montañas Swartberg y Langberg y Baviaans) y es parafilético con respecto a B. albanica en el árbol genético mitocondrial. Aunque comúnmente se conoce como la «víbora roja», ese morfotipo parece estar restringido al Cederberg (Marais 2020), mientras que el patrón común y más extendido parece ser el gris oscuro contrastado.

Bitis xeropaga solo se puede encontrar en algunas montañas rocosas del valle del río Orange en el valle del río Fish y en el sur de Namibia, y su color varía mucho dependiendo de la coloración de las rocas en su hábitat.

Concluyendo con este subgénero, hay algunas especies de víboras enanas del «clado rupícola»: Bitis inornata, Bitis albanica y Bitis armata tienen un rango geográfico muy pequeño y están limitadas a unos pocos hábitats de montaña o costa (Phelps 2010).



3) MACROCERASTES
Este es el subgénero de las víboras del bosque. Hay un gran clado dentro de las especies, Bitis gabonica (Duméril, Bibron y Duméril 1854) y Bitis rhinoceros (Schlegel 1855), a menudo llamadas víboras de Gabón de África occidental y oriental. Las Bitis nasicornis (Shaw 1792) se conocen como víboras rinoceronte y la endémica Bitis parviocula, de Etiopía, se conoce como víbora de la montaña Bale, Bohme 1977.
Como decíamos al principio, las especies Macrocerastes son principalmente víboras forestales, son serpientes típicas de la selva y las áreas agrícolas en los bordes de las selvas.
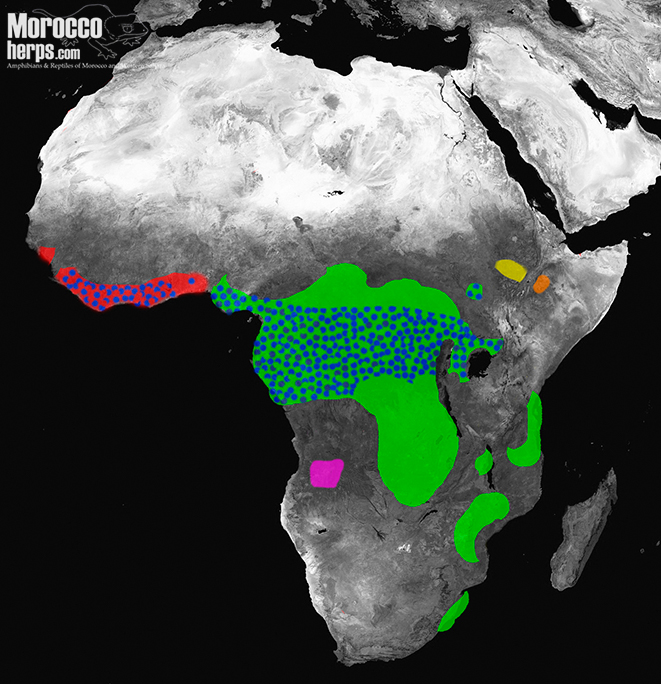

Bitis gabonica es conocida como la especie con los colmillos más largos de cualquier especie de serpiente en la Tierra, algunos alcanzando longitudes de hasta 5 cm (2 pulgadas). Aunque esta especie se puede encontrar en hábitats de campos agrícolas, son especies típicas de bosques primarios y secundarios que tienen un patrón dorsal que combina notablemente bien con el suelo del bosque de hojas muertas


Bitis rhinoceros se consideraba anteriormente una subespecie de Bitis gabonica, con aspectos similares de comportamiento y preferencia de hábitat. Ambas son algunas de las serpientes más impresionantes del mundo y, a pesar de su gran tamaño (pueden alcanzar longitudes de hasta 175 cm; Spawls et al. 2004), a menudo permanecen completamente desapercibidas en su hábitat nativo.
Bitis nasicornis es considerada una de las joyas de la fauna africana. Por lo general, muestran patrones de color sorprendentes y tienen dos escamas grandes y pronunciadas en el hocico. Aunque tienen un método de locomoción algo lento e incómodo en la forma en que se mueven, que es similar a otras especies de víboras grandes en este género, algunos registros de esta especie son de individuos que se encuentran en ramas de grandes árboles a 2-3 metros por encima del suelo. Este comportamiento arbóreo es muy raro en las víboras del Viejo Mundo, excepto en el género Atheris Cope 1862, y muy excepcionalmente en otros géneros (Macrovipera, Nilson et al., 1999; Vipera, Aleksandar Simovic, pers.comm.). Y es único dentro del género Bitis, donde el comportamiento arbóreo no es típico (Marlow et al., 2003).

Bitis parviocula, que es diferente al resto de especies en el subgénero, no tiene ornamentaciones en la cabeza, y puede tener un vivo color amarillento brillante.

Bitis harenna Gower, Wade, Spawls, Bohme, Buechley, Sykes & Colston 2016 fue la especie más recientemente descrita del género, y había sido considerada previamente una población de Bitis parviocula (Wallach et al. 2014), así que es muy posible que pertenezca a este gran clado.

La especie, Bitis heraldica (Bocage 1889) es una de las víboras menos conocidas en África. Aunque en el pasado fue considerado sinónimo de Bitis peringueyi por Boulenger (Gonçalves et al.2019), se incluye aquí en el subgénero Macrocerastes debido a su selección de hábitat, que no es el hábitat rocoso o arenoso típico del subgénero Calechidna, y debido a su rango de distribución, que se extiende lejos de Sudáfrica que parece ser el origen del subgénero Calechidna (ver Fig. 6). Análisis genéticos recientes colocan a B. heraldica entre otros miembros del subgénero Macrocerastes (Ceríaco et al.2019).

4) KENIABITIS
Este subgénero solo comprende la especie, Bitis worthingtoni Parker 1932, una víbora de tamaño mediano con una longitud máxima de 50 cm, endémica del Valle del Rift de Kenia.
Después del subgénero de Bitis arietans, Bitis, Keniabitis es el subgénero genético más distante dentro del resto de las especies de Bitis (Barlow et al. 2019).
Al igual que Bitis caudalis, esta especie también tiene cuernos sobre los ojos, y característicamente un patrón de dos líneas longitudinales dorsales en ambos lados del cuerpo, desde el cuello hasta la cola.


LA FUNCIÓN DE LOS CUERNOS
En general, la existencia de cuernos en las serpientes provoca muchos debates. En las especies dentro del género Bitis, hay cuernos encima de los ojos o del hocico, aunque todavía no se conoce por completo una causa clara de esto.
Klauber (1956) mencionó que los cuernos en los Crotalus cerastes sirven como radiadores de calor o como cortinas para los ojos. Cowles (1953) los consideró simplemente como un capricho de la evolución. Cohen y Myres (1970) sugieren que tienen la función de un párpado que protege los ojos de la serpiente mientras se arrastra por las madrigueras. Wagner y Wilms (2010) sugirieron que quizás los cuernos en las víboras podrían tener una función sexual como en otros grupos de reptiles (por ejemplo, Chamaeleonidae Gray 1825 o Agamidae Spix 1825).
La mayoría de estas teorías no son muy consistentes. En el caso del cuerno / cuernos en el hocico, algunas serpientes, como Ahaetulla pulvurulenta (Duméril, Bibron y Bibron 1854), Gonyosoma boulengeri Mocquard 1897 o Langaha madagascariensis Bonnaerre 1790, se postula que la función principal de estos cuernos podría ser ayuda en el camuflaje de las serpientes en las ramas (con una posible función sexual en Langaha debido a las diferentes formas del cuerno en machos y hembras; Glaw y Vences 2007), y en otros casos, como en Erpeton tentaculatum Lacépède 1800, los cuernos o los tentáculos tienen una función sensorial para ayudar a las serpientes a pescar (Catania et al., 2010). En las víboras, está claro que no puede ser un capricho de la evolución porque podemos encontrar tales ejemplos en muchos géneros en diferentes regiones del mundo. Encontramos un claro ejemplo en dos víboras europeas: Vipera latastei Bosca 1878 y Vipera ammodytes Linnaeus 1758. El cuerno debe tener una razón viable para su desarrollo teniendo en cuenta que dos víboras diferentes han evolucionado cuernos, aunque uno está formado por unas escamas alargadas y el otro cuerno está compuesto por muchas escamas granulares.

La teoría de que los cuernos son necesarios para proteger los ojos de una serpiente mientras está en madrigueras tampoco es completamente válida, porque la mayoría de las especies de serpientes que pasan tiempo bajo tierra en madrigueras de mamíferos y grietas estrechas no tienen cuernos en sus hocicos o encima de sus ojos. Incluso dentro de Bitis, hay especies con cuernos y sin cuernos que ocupan hábitats desérticos o montañosos, como en Cerastes sp. por ejemplo, donde hay numerosas poblaciones de serpientes sin cuernos, como en la subespecie Cerastes cerastes mutila descrita por Sochurek (1979) y Cerastes gasperetti mendelssohni Werner & Sivan en Werner et al 1999.
Aunque los cuernos pueden tener una función sexual, dado que en algunas especies ambos sexos tienen cuernos, tal vez la razón no sea por la competencia de los machos, sino posiblemente una forma en que las víboras pueden utilizar cuernos para la estimulación sexual.
Otra hipótesis podría ser que los cuernos parecen vegetación de plántulas o brotes recién emergidos que pueden atraer a los roedores hacia ellos (como un tipo de señuelo), esto también puede explicar por qué Bitis peringueyi o Cerastes vipera no poseen cuernos, ya que Bitis peringueyi o Cerastes vipera se alimentan principalmente de lagartijas, mientras que Bitis caudalis, Cerastes cerastes y Crotalus cerastes predan sobre pequeños mamíferos (Shine et al., 1998; Mallow et al., 2003; Webber et al., 2016). Estas tres especies de serpientes cornudas generalmente están parcialmente enterradas, por lo que sus presas de roedores solo verían dos pequeñas estructuras parecidas a plantas antes de ser atacadas. Sin embargo, esta hipótesis parece dudosa teniendo en cuenta que vemos cuernos por encima de los ojos en muchas serpientes arbóreas que rara vez se alimentan de roedores (por ejemplo, Atheris Cope 1862 o Bothriechis Peters 1859).
La probable razón evolutiva de la presencia de cuernos podría ser solo para el camuflaje dentro del hábitat de la serpiente. En el ejemplo donde tres especies de víboras de diferentes regiones del mundo viven en hábitats similares (Bitis caudalis, Cerastes cerastes y Crotalus cerastes) que tienen cuernos, indica que es probable que haya una razón importante para poseer cuernos y es un ejemplo de convergencia evolutiva. Además, observando en detalle el género Pseudocerastes, es evidente que sus cuernos están compuestos de escamas granulares (similares a las de V. ammodytes en el hocico), lo que respalda aún más la importancia de los cuernos en estas especies. Y, aunque las víboras de cuernos falsos pueden vivir en áreas arenosas, son más típicamente una especie que habita en rocas que emboscan a sus presas o se colocan dentro de las grietas de las rocas sin enterrarse.
Concluyendo con esta parte, se mencionará la hipótesis de los cuernos para la defensa. Juan Timms comentó al autor que, según su experiencia tanto en el campo como con víboras en cautividad, la función de los cuernos supraoculares debería ser proteger los ojos cuando capturan una presa. Los roedores, lagartos o pájaros tienen la capacidad de arañar con las patas y rajar los ojos de la serpiente. De hecho, todas las víboras de cuernos supraoculares, arbóreas o terrestres, tienden a aguantar las presas cuando las cazan, no como otras víboras que muerden y sueltan, y luego se comen la presa muerta.


CONCLUSIONES
Hay muchos géneros de serpientes en el mundo, algunos con adaptaciones extremas a casi todos los hábitats. El género Bitis tiene una distribución restringida principalmente a África, pero sus especies han evolucionado para adaptarse a todos los hábitats africanos: las zonas costeras, los desiertos, las selvas tropicales, las sabanas, los pastizales y las regiones de alta montaña. La variabilidad fenotípica de estas víboras varía desde las especies más pequeñas en la tierra hasta aquellas con los colmillos más grandes. La coloración general de sus diversas especies varía desde fondos típicos de color marrón arena a fondos muy oscuros y puede incluir tonos de amarillo, rojo, verde e incluso azul. Algunas especies de Bitis incluso tienen las ornamentaciones de la cabeza más espectaculares entre todas las serpientes vivas, y a pesar de las muchas hipótesis, no hay teorías concluyentes sobre la función de estos cuernos en el hocico o encima de los ojos.
La presencia del género Bitis en Marruecos es una prueba de la plasticidad ecológica de este género en diferentes entornos. Las Bitis son animales extremadamente adaptables que pueden ser comunes, a pesar de que la presencia de muchas otras especies de víboras o depredadores en la misma región.
AGRADECIMIENTOS
A Paul Freed, Fernando Martínez-Freiría y Dylan Leonard por su inestimable ayuda con fotos y la revisión de este artículo. A Keir y Alouise Lynch, Jonas Arvidsson, Juan Timms, Luis Ceríaco, Dayne Braine, Jurgen Gebhart, Jo Balmer, Alex Rebelo, Tomas Mazuch, Alberto Sánchez Vialas, Felix Hulbert y Krystal Tolley por su ayuda con fotos o permiso para el uso de varios documentos en este artículo.
BIBLIOGRAFÍA
- Arnold EN. 1980. The scientific results of the Oman flora and fauna survey 1977 (Dhofar). The reptiles and amphibians of Dhofar, southern Arabia. Journal of Oman Studies Special Report (No. 2): 273-332
- Barlow A, Baker K, Hendry CR, Peppin L, Phelps T, Tolley KA, Wüster CE, Wüster W. 2013. Phylogeography of the widespread African puff adder (Bitis arietans) reveals multiple Pleistocene refugia in southern Africa. Molecular Ecology, 22, 1134–1157
- Barlow A, Wüster W, Kelly CMR, Branch WR, Phelps T, Tolley KA. 2019. Ancient habitat shifts and organismal diversification are decoupled in the African viper genus Bitis (Serpentes: Viperidae). J Biogeogr. 00:1–15
- Bouazza A, Laïdi K, Martín J. 2020. New record of the Sahara sand viper, Cerastes vipera (Linnaeus, 1758), from north-eastern Morocco. Herpetology Notes 13: 203-205
- Carranza S, Xipell M, Tarroso P, Gardner A, Arnold EN, Robinson MD, et al. 2018. Diversity, distribution and conservation of the terrestrial reptiles of Oman (Sauropsida, Squamata). PLoS One 13 (2): e0190389
- Catania KC, Leitch DB, Gauthier D. 2010. «Function of the appendages in tentacled snakes (Erpeton tentaculatus)». Journal of Experimental Biology 213: 359-367
- Ceríaco L, Tolley K, Marques M, Heinicke M, Blackburn D, Bauer A. 2019. A Dwarf among giants: Biogeography and Phylogenetic Position of the Elusive Angolan Adder, Bitis heraldica (Bocage, 1889). African Herp News 72: 51-52.
- Cohen AC, Myres BC. 1970. A function of the horn in the sidewinder rattlesnake Crotalus cerastes, with comments on other horned snakes. Copeia 3, 574-5.
- Das I. 2012. A Naturalist’s Guide to the Snakes of South-East Asia: Malaysia, Singapore, Thailand, Myanmar, Borneo, Sumatra, Java and Bali. John Beaufoy. 160 pp.
- Dobiey M, Vogel G. 2007. Venomous Snakes of Africa. Giftschlangen Afrikas. Edition Chimaira, Frankfurt.
- Fitzsimons V. 1959. Some new reptiles from southern Africa and southern Angola. Annals Transvaal Mus. 23:405-409
- Glaw F, Vences M. 2007. A Field Guide to Amphibians and Reptiles of Madagascar 3rd edition. Köln: M. Vences & F. Glaw Verlags GbR
- Gloyd HK, Conant R. 1990. Snakes of the Agkistrodon Complex: A Monographic Review. Society for the Study of Amphibians and Reptiles. 614 pp.
- Gonçalves FMP, Braine D, Bauer AM, Valério HM, Marques MP, Ceríaco LMP. 2019. Rediscovery of the poorly known Angola Adder, Bitis heraldica (Bocage, 1889) (Serpentes: Viperidae): new records, live photographs, and first case history of envenomation Herpetological Review 50 (2): 241-246
- Gower DJ, Wade EOZ, Spawls S, Böhme W, Buechley ER, Sykes D, Colston TJ. 2016. A new large species of Bitis Gray, 1842 (Serpentes: Viperidae) from the Bale Mountains of Ethiopia Zootaxa 4093 (1): 041–063
- Jiménez-Robles O, León R, Soto Cárdenas M, Rebollo B, Martínez G. 2017. Contributions to the natural history and distribution of Dasypeltis sahelensis Trape & Mané, 2006, in Morocco. Herpetozoa 30 (1/2), 80–86
- Klauber LM. 1956. Their habits, life histories, and influence on mankind. Univ. California Press
- Lenk P, Herrmann H-W, Joger U, Wink M. 1999. «Phylogeny and Taxonomic Subdivision of Bitis (Reptilia: Viperidae) based on molecular evidence». Kaupia. 8: 31–38.
- Malhotra A, Thorpe RS. 2004. A phylogeny of four mitochondrial gene regions suggests a revised taxonomy for Asian pitvipers (Trimeresurus and Ovophis). Molecular Phylogenetics and Evolution 32, 83-100.
- Mallow D, Ludwig D, Nilson G. 2003. True Vipers: Natural History and Toxinology of Old World Vipers. Krieger Publishing Company, Malabar, Florida. 359 pp
- Mallow D, Ludwig D, Nilson G. 2004. True Vipers: Natural History and Toxinology of Old World Vipers. Malabar, FL: Krieger Publishing Company.
- Marais J. 2004. A Complete Guide to the Snakes of Southern Africa, 2nd ed. Struik Publishers, 312 pp.
- Marais J. 2020. Dwarf Adders of Southern Africa. africansnakebiteinsitute.com. Consulted the 17 of March of 2020
- Martínez del Mármol G, Harris DJ, Geniez P, de Pous P, Salvi D. 2019. Amphibians and Reptiles of Morocco. Frankfurt, Germany, Edition Chimaira. 478 pp.
- McDiarmid RW, Campbell JA, Touré T. 1999. Snake Species of the World: A Taxonomic and Geographic Reference, vol. 1. Herpetologists’ League. 511 pp.
- Mehrtens JM. 1987. Living Snakes of the World in Color. New York: Sterling Publishers. 480 pp.
- Miller AK, Maritz B., McKay S, Glaudas X, Alexander GJ. 2015. An ambusher´s arsenal: chemical crypsis in the puff adder (Bitis arietans). Proceedings of the Royal Society B: Biological Sciences, 2015; 282 (1821)
- Nilson G, Andrén C, Ioannidis Y, Dimaki M. 1999. Ecology and conservation of the Milos viper, Macrovipera schweizeri (Werner, 1935). Amphibia Reptilia;20(4): 355-75
- Phelps T. 2010. Old world vipers. A natural history of the Azemiopinae and Viperinae. Frankfurt am Main: Edition Chimaira.
- Pyron RA, Burbrink FT, Wiens JJ. 2013. A phylogeny and revised classification of Squamata, including 4161 species of lizards and snakes. BMC Evolutionary Biology, 13(1), 93.
- Shi J, Wang G, Chen X, Fang Y, Ding L, Huang S, Hou M, Liu J, Li P. 2017. A new moth-preying alpine pit viper species from Qinghai-Tibetan Plateau (Viperidae, Crotalinae) Amphibia-Reptilia, 38 (4): 517 – 532
- Shine R, Branch WR, Harlow PS, Webb JK. 1998. Reproductive Biology and Food Habits of Horned Adders, Bitis caudalis (Viperidae), from Southern Africa. Copeia (2): 391-401.
- Sochurek E. 1979. Die Schlangen Nordafrikas. Mitt. Zool. Ges. Braunau 3 (8/9): 219-226
- Spawls S, Howell K, Drewes R, Ashe J. 2004. A Field Guide to the Reptiles of East Africa. A & C Black Publishers Ltd., London. 543 pp.
- Wagner P, Wilms TM. 2010. A crowned devil: new species of Cerastes Laurenti, 1768 (Ophidia, Viperidae) from Tunisia, with two nomenclatural comments. Bonn Zool. Bull. 57 (2): 297–306
- Wallach V, Williams KL, Boundy J. 2014. Snakes of the World: A Catalogue of Living and Extinct Species. [type catalogue] Taylor and Francis, CRC Press, 1237 pp.
- Webber MM, Jezkova T, Rodríguez-Robles JA. 2016. Feeding Ecology of Sidewinder Rattlesnakes, Crotalus cerastes (Viperidae). Herpetologica: December 2016, Vol. 72, No. 4, pp. 324-330.
- Werner YL, Sivan N, Kushnir V, Motro U. 1999. A statistical approach to variation in Cerastes (Ophidia: Viperidae) with the description of two endemic subspecies, In U. Joger. (ed.): Phylogeny and Systematics of the Viperidae. Kaupia (Darmstadt) (8): 83-97
Para citar este artículo:
Martínez del Mármol (2020): La variabilidad fenotípica del género Bitis Gray 1842, con comentarios en su parecido con otras víboras. En: Martínez, G., León, R., Jiménez-Robles, O., González De la Vega, J. P., Gabari, V., Rebollo, B., Sánchez-Tójar, A., Fernández-Cardenete, J. R., Gállego, J. (Eds.). Moroccoherps. Amphibians and Reptiles of Morocco and Western Sahara.
Para citar www.morocoherps.com en su conjunto:
Martínez, G., León, R., Jiménez-Robles, O., González De la Vega, J.P., Gabari, V., Rebollo, B., Sánchez-Tójar, A., Fernández-Cardenete, J.R., Gállego, J. (Eds.). Moroccoherps. Amphibians and Reptiles of Morocco and Western Sahara.
Available from www.moroccoherps.com.

